绿叶色素提取实验:碳酸钙的“守护”之道——为何其他碱性盐难以替代?
在高中生物必修经典实验——“绿叶中色素的提取和分离”中,研磨叶片时加入的那一小勺不起眼的碳酸钙(CaCO₃)粉末,扮演着至关重要的“守护者”角色。我们都知道它是用来“防止色素被破坏”的。时常会有学生质疑:它究竟如何保护色素?能否用其他溶于水的碱性盐(如碳酸钠 Na₂CO₃、碳酸氢钠 NaHCO₃、氢氧化钠 NaOH)来替代? 今天,我们就来深入剖析一下这个实验细节背后的生化原理。
破坏者:酸与氧化的威胁
绿叶细胞液泡中含有多种有机酸(如草酸、苹果酸等)。在研磨过程中,细胞结构被破坏,这些酸会释放出来。同时,研磨产生的机械损伤和暴露于空气中的氧气,也为氧化破坏创造了条件。
叶绿素(尤其是叶绿素a和b)是色素家族中最“娇贵”的成员。它们的核心是一个卟啉环,环中心络合着一个镁离子(Mg²⁺)。这个结构对酸性环境和氧化剂极其敏感:
1、酸破坏(脱镁作用):
当环境中H⁺浓度升高(酸性条件),H⁺会竞争性地替换掉卟啉环中心的Mg²⁺,形成脱镁叶绿素。
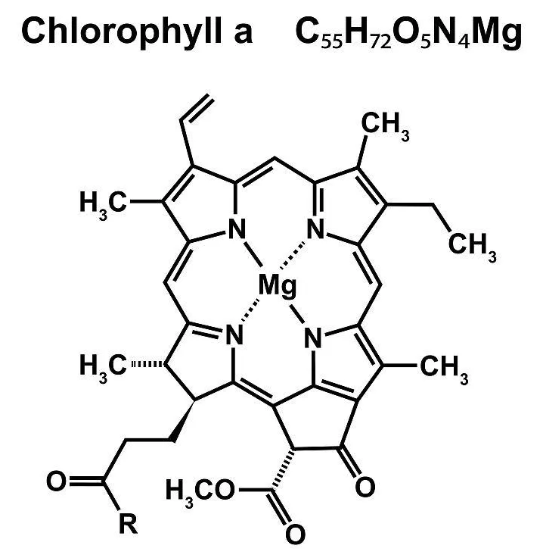
脱镁叶绿素呈橄榄绿色或褐色,失去了原有的鲜绿色,并且水溶性增加。这不仅导致提取液颜色失真(偏黄褐色),在后续的纸层析中,脱镁叶绿素可能不会在正常位置形成清晰的色素带,甚至可能不显现或扩散,严重影响实验结果。
2、氧化破坏:
空气中的氧气在研磨等过程中可能氧化叶绿素或其他色素,导致它们降解、褪色或结构改变。
守护者:碳酸钙的独特保护机制
碳酸钙(CaCO₃)正是针对上述威胁中的酸破坏而设计的解决方案。它的保护机制精妙而有效:
1、温和中和酸性物质:
CaCO₃ 本身微溶于水,其水溶液呈弱碱性。
研磨过程中释放的H⁺会与碳酸钙反应:2H⁺ + CaCO₃ → Ca²⁺ + CO₂↑ + H₂O。
这个反应持续而温和地中和研磨体系中产生的酸,维持研磨液环境接近中性或微碱性,有效防止H⁺对叶绿素分子中Mg²⁺的置换(脱镁作用),保护叶绿素分子的完整性,维持其鲜绿色。
2、弱碱性环境的优势:
弱碱性环境本身也有助于稳定叶绿素结构。强碱性环境(如使用NaOH)反而可能破坏叶绿素,导致皂化反应或形成其他不稳定产物。
3、“缓冲”效应:
虽然CaCO₃溶解度不高,但在研磨产生的局部酸性环境中,它能持续溶解并消耗H⁺。这种特性提供了一定的缓冲能力,能更有效地应对研磨初期酸浓度可能较高的冲击。
能否用其他溶于水的碱性盐替代碳酸钙?
理解了碳酸钙的作用机制,这个问题就有了清晰的答案:原则上,不推荐,尤其不能用强碱性盐。
为什么其他碱性盐不是理想替代品?
1、碱性过强(如 NaOH, Na₂CO₃):
氢氧化钠 (NaOH): 强碱,水溶液碱性极强。高浓度的OH⁻会严重破坏叶绿素结构,可能导致:
皂化反应: 叶绿素分子中的植醇侧链(亲脂性)被水解脱落,形成水溶性更强的脱植醇叶绿素,颜色可能变黄绿或褐色。
卟啉环破坏: 强碱可能直接破坏卟啉环结构,导致色素完全降解、褪色。
结果: 提取液颜色异常(可能黄绿、褐绿甚至无色),层析结果混乱或失败。
碳酸钠 (Na₂CO₃): 虽然碱性比NaOH弱(水解产生OH⁻和HCO₃⁻),但其水溶液碱性仍显著强于CaCO₃溶液。浓度稍高时,也可能引起皂化反应或对色素造成其他破坏,导致提取液颜色不如使用CaCO₃时鲜绿、纯正。
2、碱性适中但引入新问题(如 NaHCO₃):
碳酸氢钠 (NaHCO₃): 水溶液呈弱碱性(pH ~8.3),理论上中和酸的能力尚可。但它存在显著缺点:
产生CO₂气泡剧烈: 与酸反应 H⁺ + HCO₃⁻ → CO₂↑ + H₂O 会产生大量CO₂气泡。在研磨时,剧烈产生的气泡会形成大量泡沫,严重干扰研磨过程,使样品难以充分研磨成匀浆,降低提取效率。泡沫还可能溢出容器,造成损失和操作不便。
缓冲能力不如CaCO₃: NaHCO₃的缓冲能力在应对研磨初期局部高酸度时可能不如CaCO₃持续有效。
3、离子效应(次要但需考虑):
使用钠盐(Na₂CO₃, NaHCO₃)会引入高浓度的Na⁺离子。虽然通常对色素稳定性影响不大,但在层析环节,高离子浓度可能略微影响色素的迁移速率(Rf值)。而CaCO₃引入的Ca²⁺浓度很低(因为溶解度低),影响可忽略。
4、结论:碳酸钙的不可替代性
弱碱性是关键: CaCO₃ 提供的温和弱碱性环境是保护叶绿素免受酸破坏(脱镁)的理想条件。强碱破坏色素,弱碱如NaHCO₃则带来操作困扰。
持续中和与缓冲: 其微溶性和与酸反应的特性,使其能在研磨过程中持续、稳定地中和局部产生的酸,提供一定的缓冲能力。
操作简便无干扰: 作为固体粉末加入,不产生剧烈气泡,不影响研磨操作。
符合标准与预期: 使用CaCO₃是教材和课程标准中的规范操作,能确保提取液呈现鲜绿色,层析得到清晰、标准的四条色素带(胡萝卜素、叶黄素、叶绿素a、叶绿素b),实验结果可靠且具有可比性。
教学启示与建议
1、讲透原理: 在教学中,不仅要告诉学生“加碳酸钙保护色素”,更要深入解释其背后的生化原理——中和酸性物质,防止H⁺置换叶绿素中的Mg²⁺(脱镁作用)导致叶绿素失绿,以及碳酸钙缓慢中和和缓冲PH的核心作用。可以展示脱镁叶绿素(橄榄绿色/褐色)的图片或进行简单演示(如向叶绿素提取液中滴加几滴稀醋酸,观察颜色变化),加深学生理解。
2、强调不可替代性: 明确告知学生,基于上述原理,实验中应严格使用碳酸钙粉末。其他碱性盐,特别是强碱性的NaOH、Na₂CO₃,会破坏色素;弱碱性的NaHCO₃则会产生大量泡沫干扰实验。这是实验设计者基于色素化学性质和操作便利性做出的最佳选择。
3、规范操作细节:
用量适中: 加入量一般为少许(黄豆粒大小或教材指定量)。过少保护不足,色素可能部分破坏;过多浪费,且大量不溶物可能干扰后续过滤或层析(通常影响不大)。
同步研磨: 将叶片、溶剂(无水乙醇或丙酮)、碳酸钙一起放入研钵中同时研磨,确保酸一产生就被及时中和。
快速操作: 研磨和过滤过程尽量迅速,减少色素暴露于空气(氧化)和可能的残留酸的时间。
4、拓展思考(可选):
对于学有余力的学生,可以引导思考:
为什么植物细胞自身含有酸却没有破坏叶绿素?(细胞区室化,酸在液泡,叶绿素在叶绿体)。
实验室更专业的提取缓冲液通常包含哪些成分?(如Tris-HCl等,它们能更精确地控制pH和渗透压,但成本高、配制复杂,不适合中学基础实验)。
结语
小小的一勺碳酸钙,在绿叶色素提取实验中绝非可有可无。它以其独特的弱碱性和微溶性,精准地扮演了“酸碱平衡守护者”的角色,有效抵御了酸性物质对叶绿素核心结构(Mg²⁺-卟啉环)的攻击,保障了我们能看到那抹鲜亮的绿色和清晰的层析图谱。它的作用原理深刻体现了生物化学的精密性,也启示我们在实验教学中,不仅要让学生知其然(操作步骤),更要引导他们知其所以然(生化原理)。理解了这个“守护”机制,关于替代品的疑问也就迎刃而解了——碳酸钙的保护,温和、持续、无干扰,是此实验情境下的最优解,难以被其他碱性盐替代。
| 
 | 加入收藏
| 学校官网
| 田径运动会
| 站点二维码 【我要留言】
| 加入收藏
| 学校官网
| 田径运动会
| 站点二维码 【我要留言】 
 | 加入收藏
| 学校官网
| 田径运动会
| 站点二维码 【我要留言】
| 加入收藏
| 学校官网
| 田径运动会
| 站点二维码 【我要留言】